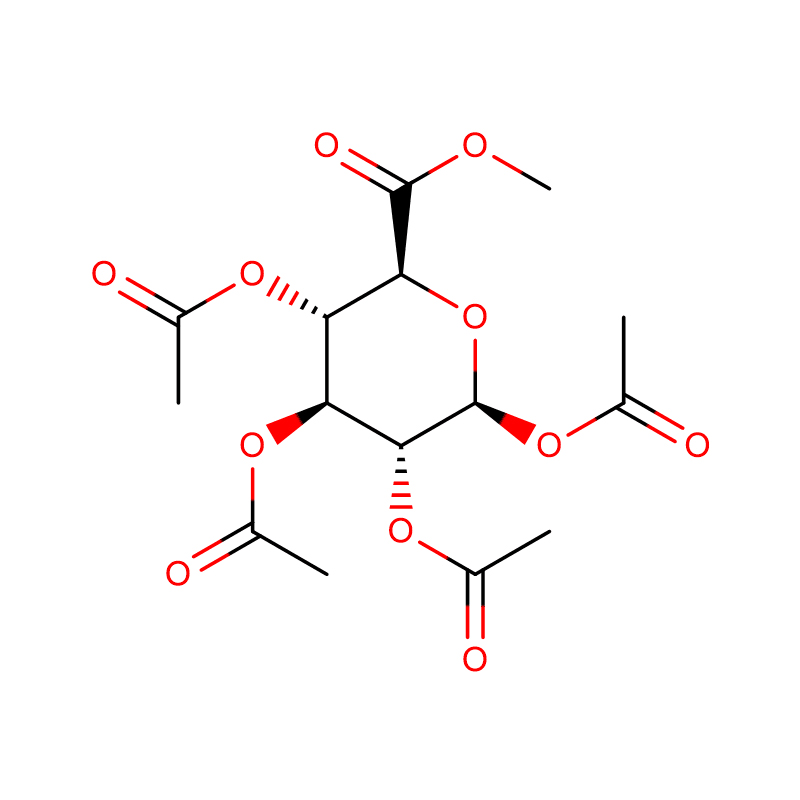
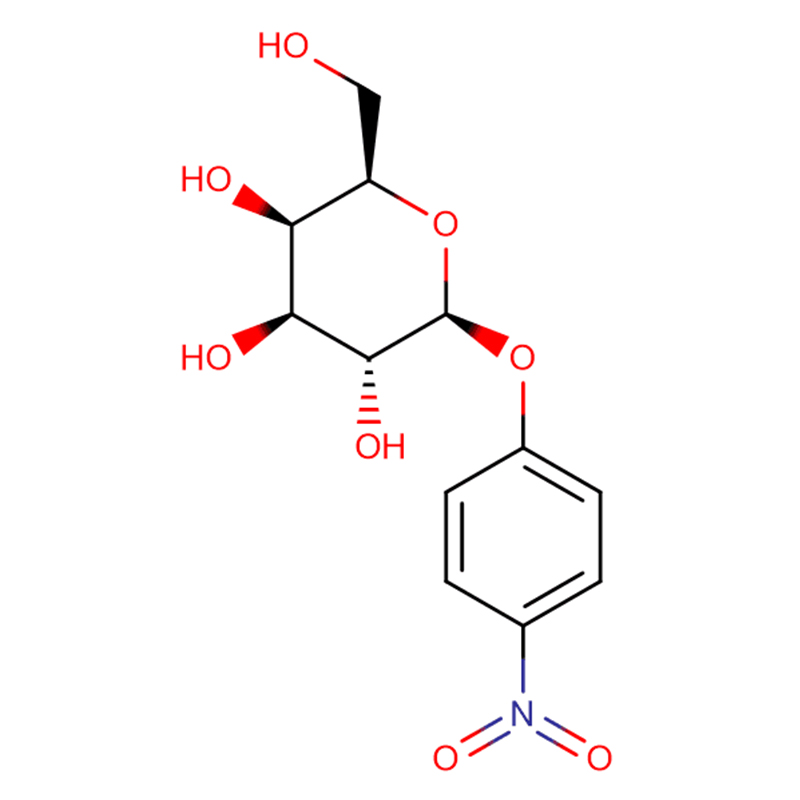
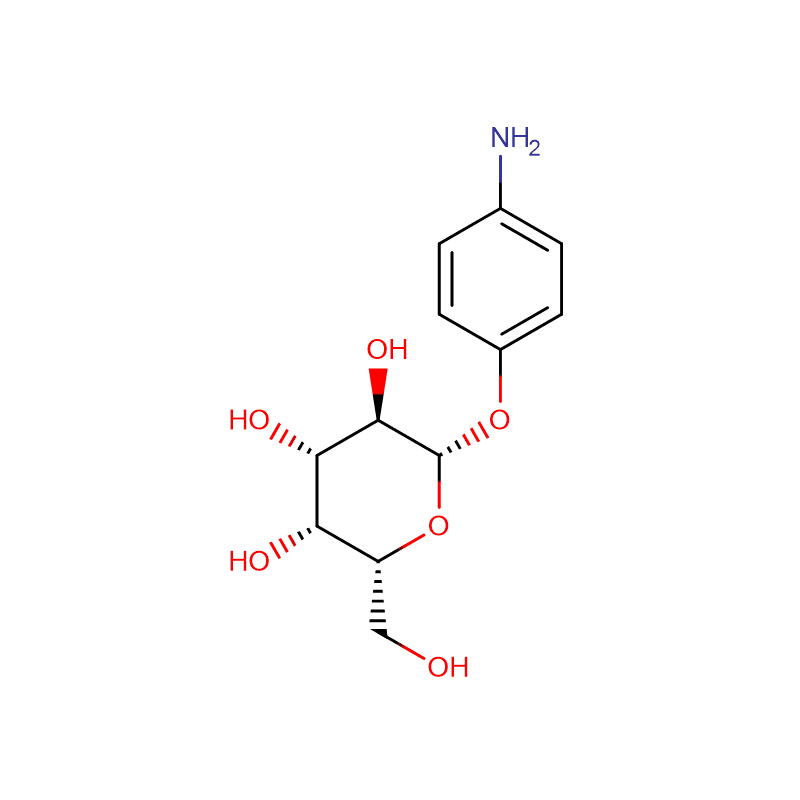
Paksusuolen bakteereilla, joista esimerkkinä on Bacteroides thetaiotaomicron, on keskeinen rooli ihmisten terveyden ylläpitämisessä valjastamalla suuria glykosidihydrolaasien perheitä (GH) hyödyntämään ravinnon polysakkarideja ja isäntäglykaaneja ravintoaineina.Tällaisesta GH-perheen laajenemisesta on esimerkkinä B. thetaiotaomicronin genomin koodaamat 23 perheen GH92-glykosidaasit.Tässä osoitamme, että nämä ovat alfa-mannosidaaseja, jotka toimivat yhden syrjäytysmekanismin kautta hyödyntäen isännän N-glykaaneja.Kahden GH92-mannosidaasin kolmiulotteinen rakenne määrittelee kahden domeenin proteiinien perheen, jossa katalyyttinen keskus sijaitsee domeenin rajapinnassa tarjoten happoa (glutamaattia) ja emästä (aspartaattia) apua hydrolyysille Ca(2+)- riippuvaisella tavalla.GH92:n kolmiulotteiset rakenteet kompleksina estäjien kanssa antavat käsityksen katalyysin spesifisyydestä, mekanismista ja konformaatioreitistä.Ca(2+):lla on keskeinen katalyyttinen rooli auttaessaan vääristämään mannosidia pois sen perustilasta (4)C(1) -tuolin konformaatiosta kohti siirtymätilaa