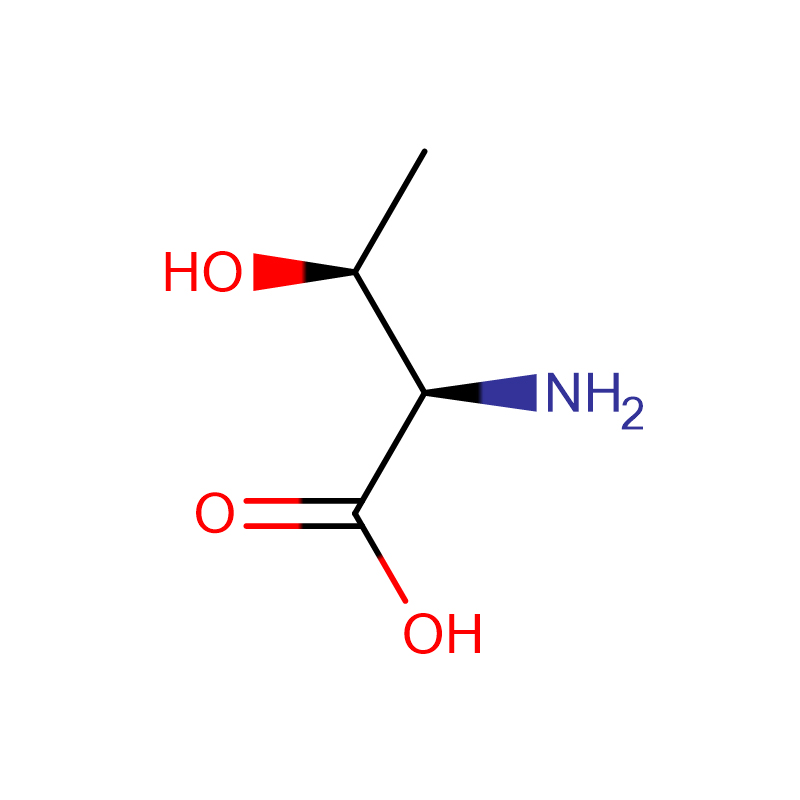
L-Proline Cas: 147-85-3 99 % Valkoinen jauhe
| Luettelonumero | XD90293 |
| tuotteen nimi | L-proliini |
| CAS | 147-85-3 |
| Molekyylikaava | C5H9NO2 |
| Molekyylipaino | 115.13046 |
| Tallennustiedot | Ambient |
| Yhdenmukaistettu tariffikoodi | 29339980 |
Tuotteen tiedot
| Määritys | 99 % min |
| Ulkomuoto | valkoinen jauhe |
| Erityinen kierto | -84,5 - -86 |
| Raskasmetallit | <15 ppm |
| AS | <1 ppm |
| Ph | 5,9 - 6,9 |
| SO4 | <0,050 % |
| Fe | <30 ppm |
| Kuivaushäviö | <0,3 % |
| Jäännös syttyessä | <0,10 % |
| NH4 | <0,02 % |
| Cl | <0,050 % |
| Ratkaisun tila | >98 % |
Mikrobiisännän aineenvaihdunnan ymmärtäminen on välttämätöntä kokosolupohjaisten biokatalyyttisten prosessien kehittämisen ja optimoinnin kannalta, sillä se määrää tuotannon tehokkuuden.Tämä pätee erityisesti redox-biokatalyysiin, jossa käytetään metabolisesti aktiivisia soluja isännässä endogeenisen kofaktorin/kosubstraatin regeneratiivisen kapasiteetin vuoksi.Rekombinanttia Escherichia colia käytettiin proliini-4-hydroksylaasin (P4H) ylituottamiseen. Dioksigenaasi katalysoi vapaan L-proliinin hydroksylaatiota trans-4-hydroksi-L-proliiniksi a-ketoglutaraatin (a-KG) kanssa kosubstraattina.Tässä kokosolubiokatalyytissä keskushiilen aineenvaihdunta tarjoaa tarvittavan kosubstraatin a-KG, joka yhdistää P4H-biokatalyyttisen suorituskyvyn suoraan hiiliaineenvaihduntaan ja metaboliseen aktiivisuuteen.Käyttämällä sekä kokeellisia että laskennallisia biologian työkaluja, kuten aineenvaihduntatekniikkaa ja (13)C-aineenvaihduntavirta-analyysiä ((13)C-MFA), tutkimme ja kuvasimme kvantitatiivisesti kokosolubiokatalysaattorin fysiologista, metabolista ja bioenergeettistä vastetta. kohdennettuun biokonversioon ja tunnistettiin mahdollisia metabolisia pullonkauloja rationaalista polkusuunnittelua varten. Proliinin hajoamispuutteellinen E. coli -kanta rakennettiin poistamalla proliinidehydrogenaasia koodaava putA-geeni.Kokosolujen biotransformaatiot tällä mutanttikannalla eivät johtaneet vain kvantitatiiviseen proliinin hydroksylaatioon, vaan myös spesifisen trans-4-L-hydroksiproliinin (hyp) muodostumisnopeuden kaksinkertaistumiseen villityyppiin verrattuna.Mutanttikannan keskusaineenvaihdunnan kautta tapahtuvan hiilivirran analyysi paljasti, että lisääntynyt a-KG:n tarve P4H-aktiivisuudelle ei lisännyt a-KG:tä tuottavaa virtaa, mikä osoittaa tiukasti säädeltyä TCA-syklin toimintaa tutkituissa olosuhteissa.Villityypin kannassa P4H-synteesi ja katalyysi aiheuttivat biomassasadon vähenemisen.Mielenkiintoista on, että ΔputA-kanta kompensoi lisäksi siihen liittyvää ATP- ja NADH-häviötä vähentämällä ylläpitoenergian tarvetta verrattain alhaisilla glukoosinottonopeuksilla sen sijaan, että se lisäisi TCA-aktiivisuutta. PutA-poiston havaittiin rekombinantti E. coli BL21(DE3)(pLysS) -bakteerissa olla lupaavia tuottavalle P4H-katalyysille, ei vain biotransformaatiosaannon suhteen, vaan myös biotransformaation ja proliinin oton nopeuksien sekä energialähteen hypyn tuoton suhteen.Tulokset osoittavat, että putA-poiston jälkeen TCA-syklin kytkemisestä proliinihydroksylaatioon kosubstraatin a-KG kautta tulee keskeinen rajoittava tekijä ja tavoite parantaa entisestään a-KG-riippuvaisten biotransformaatioiden tehokkuutta.